Ⅲ.白血病の染色体情報を読み解く
- 染色体検査は造血器腫瘍の診断にとって必須の検査である。特異的な染色体転座の多くではキメラ遺伝子が形成され、治療方針の決定にとって重要な情報を提供する。
- 特異的染色体異常が見つからなかったときにも、核型情報の中には多くの手掛かりがある。特に、記載された切断点が腫瘍関連遺伝子の座位する部位であるかどうかを丁寧に確認することが大切である。
- 分染法は染色体の形と白黒のバンドのパターンにより染色体の種類や構造異常を判定する形態診断法である。1つの細胞中に含まれる全ての染色体を細胞単位で同時に観察できる一方で、その解像度の限界も理解しておく必要がある。
- FISH(fluorescence in situ hybridization)法は蛍光標識プローブを用いることにより、染色体が形成されていない核(間期核)においても目的のDNA塩基配列の位置を観察することができる(間期核FISH)。
- 分裂核の24種類の染色体を異なる色に染め分けるSKY(spectral karyotyping)法(または multicolor FISH 法; mFISH法)では、分染法だけでは判別が難しい複雑な染色体異常をより正確に診断することが可能になる。
- 細胞の中で染色体が形成されているのは細胞周期のうちの分裂期のみである。染色体検査成功の鍵は、如何にして分裂期(通常は分裂中期)の細胞を十分に集めることができるかによる。
1.正しい結果を得るために知っておきたい検体取り扱いの注意点
(1)染色体検査は可能な限り骨髄液で行う
白血病の染色体検査を行うときは骨髄液で行うことが望ましい。十分な白血病細胞が含まれていれば末梢血での検査も可能であるが、骨髄液に比べて成功率が劣る。ドライタップなどで骨髄液が十分採取できない場合を除き、可能な限り骨髄液で検査を行う。
(2)なぜ抗凝固剤はヘパリンを使うのか?
ヘパリンはアンチトロンビンの作用を増強することにより抗凝固作用を示し、細胞機能検査に用いる血液を採取するときに使われる抗凝固剤である。染色体分染法では、染色体の観察に適した分裂中期(M期)の細胞を得るために培養が行われる。ヘパリン以外の抗凝固剤はカルシウムを除去することによって抗凝固作用を示し、分染法に必要な細胞分裂を阻害するため、染色体検査用の検体に用いてはならない。
2.染色体検査報告書をどのように読んだらよいか
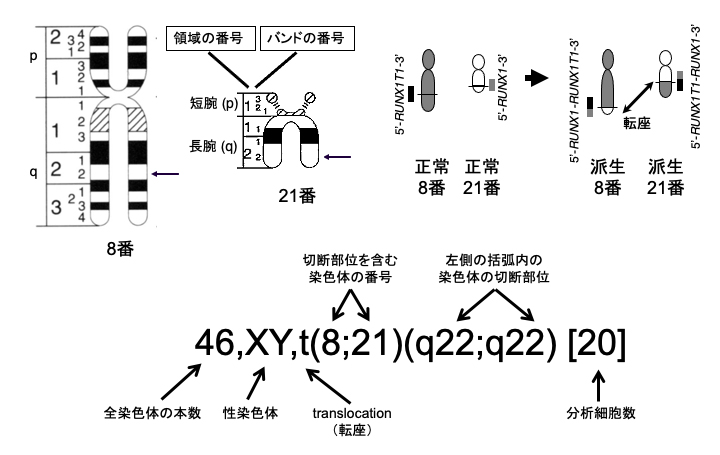
(1)核型(かくがた)はISCNにしたがって記載される
核型は全てISCN(International System for Human Cytogenetic Nomenclature)にしたがって記載される 1)。白血病細胞の核型表記の構造を図1に、よくみられる記号を表1に示したが、意味がわからない記号や記載を見たときは、是非ISCNの説明を読んでいただきたい。
(2)まず典型的な染色体異常の有無を確認する
何らかの異常が認められたときは、まずWHO分類に含まれる反復性染色体異常かどうかを確認する。WHO分類には含まれていなくても、何らかの反復性染色体異常が見つかれば診断的価値は高い。ただし、次の点に注意が必要である。
①染色体番号だけでなく切断点を見る
たとえば、AMLの予後不良因子であるFUS(TLS)-ERGはt(16;21)(p11.2;q22)により形成されるが、AMLでのt(16;21)には、切断点も融合遺伝子も全く異なるt(16;21)(q24;q22):RUNX1(AML1)-CBFA2T3(MTG16)があり、注意が必要である。FUS(TLS)-ERG陽性例は高リスク群となるが、RUNX1(AML1)-CBFA2T3(MTG16)陽性例の予後は不良ではない。このようなことはt(16;21)に限ったことではない。
②切断点が同じでも関与する遺伝子がいつも同じとは限らない
t(11;19)(q23;p13.3)はAMLでしばしばみられる染色体転座であり、もっとも高頻度にみられるキメラ遺伝子はKMT2A(MLL)-ELLである。しかし、19p13.3領域には複数のKMT2A(MLL)の相手遺伝子が存在する。RT-PCRでKMT2A(MLL)-ELLを検出できなかった場合は、KMT2A(MLL)と他の遺伝子のキメラ遺伝子の存在の可能性を考慮する。このような例も他にもいくつも存在する。これらを染色体レベルで区別することは不可能であり、遺伝子解析と合わせた判断が必要である。
(3)染色体異常の構造がいつも単純であるとは限らない
①反復性染色体異常に派生した染色体異常
反復性染色体異常にはさまざまな付加的染色体異常を伴うことが多い。核型記載の中にt(8;21)(q22;q22.1)やt(9;22)(q34;q11.2)などの記載が見えればその判断は難しくない。しかし実際には、さまざまな形で反復性染色体異常が隠れていることがある。
46,XY,t(8;16;21)(q22;p11.1;q22)という染色体転座を見たとき、どのように考えるか?(文献2)、表3のケース7)この染色体異常の中にt(8;21)(q22;q22.1)やt(16;21)(p11;q22.1)が見えるだろうか?本症例ではRUNX1(AML1)-RUNX1T1(ETO)が陽性であったことから、転座の中心はt(8;21)(q22;q22.1)であり、t(8;21)が形成される際に16番染色体も巻き込んだ3-way転座が生じたことで説明がつく。しかし、もしRUNX1(AML1)-RUNX1T1(ETO)が検出されなかった場合には、t(16;21)(p11;q22.1)によるFUS(TLS)-ERGの可能性を考慮する必要がある。染色体検査だけでなくキメラ遺伝子検査を併用することによって初めて正確な診断が可能になる重要なケースであり、このようなケースは決して珍しいものではない。
45,X,-X,t(6;8)(q27;q22)が検出され、キメラ遺伝子スクリーニングではRUNX1(AML1)-RUNX1T1(ETO)が陽性であった例ではどうだろうか?(文献2)、表3のケース8)RUNX1(AML1)-RUNX1T1(ETO)が形成される t(8;21)(q22;q22.1)は検出されなかったが、追加で行ったFISH検査でRUNX1(AML1)とRUNX1T1(ETO)の融合シグナルが観察できたことから、複雑な染色体異常によってt(8;21)の存在がマスクされている可能性が示唆された。RUNX1(AML1)-RUNX1T1(ETO)が形成されているのにもかかわらずGバンドでのt(6;8)(q27;q22.1)という核型診断の結果を総合して考えると、この症例ではt(6;21;8)(q27;q22;q22.1)という3-way転座が生じていると予想された。
②構成的(先天性の)変異がある染色体に反復性染色体異常が生じると核型記載が複雑になる
腫瘍細胞の染色体検査を行った時に、inv(9)(p11q13)/inv(9)(p13q13)のような異常が観察されることが時々ある。inv(9)(p11q13)/inv(9)(p13q13)は一般集団の1~2.5%に認める正常変異で、通常は腫瘍化とは関係がない。そのほかにinv(1)(p13q21)/inv(1)(p13q12)なども正常変異として知られており、このような異常が観察された時に腫瘍特異的な異常なのか正常変異なのかをしっかり区別することが重要である。
46,XY,der(9)inv(9)(p12q13)t(9;22)(q34;q11.2),der(22)t(9;22)(文献2)、表3のケース16)という核型は非常に複雑に見えるが、実際には単純なt(9;22)(q34;q11)である。正常変異であるinv(9)(p12q13)をもつ染色体にt(9;22)(q34;q11)が生じるとこのような核型記載になる。
45,X,-X,der(8)inv(8)(p21q22)t(8;21)(q22;q22),der(21)t(8;21)(p21;q22)(文献2)、表3のケース6)も同様で、inv(8)(p21q22)を持った8番染色体が21番染色体との間で相互転座をしたと考えられる。
③常に複雑な染色体異常になる反復性キメラ遺伝子もある
KMT2A(MLL)-MLLT10(AF10)を形成する染色体転座は通常t(10;11)(p12;q23)と記載されるが、実際にこのような単純な転座が観察されることはほとんどない。その理由はKMT2A(MLL)とMLLT10(AF10)の染色体上での遺伝子の向きの違いにある13)。KMT2A(MLL)が11番染色体長腕上でセントロメアからテロメア方向を向いているのに対して、MLLT10(AF10) は10番染色体上をテロメアからセントロメア方向を向いている。そのため、両者の単純な相互転座では KMT2A(MLL)の 5'側と MLLT10(AF10) の 3'側が融合することができず、必ずどちらかの一部を含む染色体断片が逆位にならなければならない。このような KMT2A(MLL)-MLLT10(AF10)の特徴を理解していれば、たとえ典型例でなくてもKMT2A(MLL)-MLLT10(AF10)の存在を疑うことができるようになる。逆位を伴った転座のため、11番の切断点がKMT2A(MLL)が存在する11q23と診断できない場合も多く、その場合はPICALM-MLLT10(AF10)の可能性も考慮されるが、FISHでKMT2A(MLL)のスプリットを確認できればPICALM-MLLT10(AF10)は除外できる。
同様のことはt(X;11)(q24;q23)によるKMT2A(MLL)-SEPT6などにも当てはまる。このような知識を持つことにより、非典型例であっても観察した染色体異常の情報を手掛かりに関与しているキメラ遺伝子をかなりの精度で予測できる場合がある。
④PML-RARAを伴う急性前骨髄球性白血病の記載から染色体転座情報が消えた
急性前骨髄球性白血病(APL)では、微細転座や複雑な転座によって、染色体レベルでt(15;17)とならない場合も多く、WHO分類2017年版からAcute promyelocytic leukemia with PML-RARAとなり、転座の記載が削除された。また、variant RARA転座と呼ばれるPML以外の相手によるキメラ遺伝子は、現在でもなお次々と同定されている。
その一方で、APLの病型を呈していながらPML-RARAが検出できない症例からRARB(retinoic acid receptor β)やRARG (retinoic acid receptor γ)が関与するキメラ遺伝子が同定されている。RARBは3p24.2、RARGは12q13.13に座位する遺伝子であるが、いずれのキメラ遺伝子を有する症例でも、核型に3q24または12q13の異常が含まれないことが多く、核型からの予測は難しい。
4.分染法では検出できない染色体異常がある
分染法では検出が難しい染色体異常としては ALL における t(12;21)(p13;q22); ETV6-RUNX1 が高頻度であり有名であるが、AMLにおいてもt(5;11)(q35;p15.5)によるNUP98-NSD1、AMKLにおけるinv(16)(p13.3q24.3); CBFA2T3-GLIS2とt(11;12)(p15;p13);NUP98-JARID1A などがある。いずれも各々の染色体の末端部の pale band(白黒の白い部分)に切断点(遺伝子)があり転座や逆位によって染色体の長さにも変化が起こらないため、通常の分染法での検出はほぼ不可能である。
以上のような特殊な染色体異常だけでなく、通常は判別可能な反復性染色体異常によって形成されるキメラ遺伝子が、本来の染色体異常とは全く関係のない核型(正常核型を含む)の症例で検出されることも珍しいことではない。
5.おわりに
染色体異常が見つかったとき、その白血病細胞にとってその異常がクローン性のものかどうか、白血病化にとって意味のある異常かどうかをまず確かめる。
しかし、このことをあえて本稿の最後に書いたのは、たとえ定義上は“クローン性の異常ではない”と判断されるような場合であっても、その中に診断の手掛かりになる異常が存在する場合があり、そのような異常をみつける機会を最初に排除すべきではないと考えるからである。
染色体分析は、通常たかだか20細胞の核型を観察して診断しているだけなので、その中にはたまたま1個しか異常細胞が見つからないということはよくあることである。元々そのクローンは非常に低頻度のクローンだったかもしれない。また、採取した検体に末梢血がたくさん混入したりなどして十分に腫瘍細胞が含まれていなかったりなど、適切な検体で検査が行われていなかった可能性もある。既知の染色体異常が見つからない場合は、たとえクローン性異常の条件を満たさない場合でも、手掛かりとなり得る染色体異常の有無を丁寧に確認することが大切である。
その際に、染色体の報告書の中に含まれている核型の写真も是非見て欲しい。この核型からそれぞれの染色体の長さやバンドのパターンからその染色体が正常なのか、どのような異常があるのかを判別する核型診断ができるようになるのにはかなりの熟練を要し、「臨床細胞遺伝学認定士」という資格が日本人類遺伝学会によって認定されているように、専門性の高い技能である。この核型診断をする技術を身につけるのは容易ではないが、記載された核型診断がどのような意味を持つのかを知ることはそれほど難しいことではないので、是非基本的な核型診断の読み方を覚えてほしい。稀な染色体異常だと思っていた中に、よくみる異常が紛れ込んでいることはよくあり、慣れてくると核型診断の記載の中からこのような異常を見つけることは決して難しいことではない。
- 1McGowan-Jordan J,et al.,eds. ISCN 2020: An International System of Human Cytogenetic Nomenclature. Basel: Karger; 2020
- 2滝 智彦,林 泰秀:染色体検査結果とキメラ遺伝子検査結果の食い違い症例の検討.日本小児血液学会雑誌 23(4): 310-314,2009
- 3 滝 智彦.分子・細胞遺伝学的診断.小児がん診療ハンドブック.堀部敬三編,pp81-87,医薬ジャーナル社,大阪,2011
- 4滝 智彦,林 泰秀.細胞遺伝学的および分子生物学的診断.小児造血器腫瘍の診断の手引き.堀部敬三,鶴澤正仁編集,pp33-45,日本医学館,東京,2012
- 5滝 智彦.染色体検査の基礎知識.小児血液・腫瘍学,日本小児血液・がん学会編集,pp5557,診断と治療社,東京,2015
- 1腫瘍に関連する未知の染色体異常を見つけた時
- 2腫瘍関連の代表的な染色体異常についての情報を集めたい時
- 3FISH 解析用プローブの情報
- 4先天異常から腫瘍までの代表的な染色体異常の解説から、各種染色体関連検査、核型表記法についてまで、染色体検査に関連する日常必要なほぼ全ての知識を得ることができる日本語のサイト
図1.白血病細胞の核型表記の構造
| 記号 | 意味 | 使用例とその説明 |
|---|---|---|
| pとq | 短腕と長腕 | 短腕の記号である“p”はフランス語の“petit”(プチ、小さい)の頭文字をとったものである。 長腕の記号である“q”には特別な意味はなく、アルファベットのpの次の文字であるqが充てられた。 |
| t | translocation 転座 | t(8;21)(q22;q22.1) 8q22と21q22.1の間の相互転座 *異なる染色体の融合(切断)点はセミコロン(;)でつなぐ |
| inv | inversion 逆位 | inv(16)(p13.1q22) 16番染色体のp13.1とq22の間での逆位 *同一染色体上の融合(切断)点の間にはセミコロン(;)は入れない |
| ins | insertion 挿入 | ins(5;2)(p14;q22q31.2) 2q22-q31.2領域の欠失と5p14への挿入 挿入された派生5番染色体上での染色体成分の順番は 5pter→5p14→2q31.2→2q22→5p14→5qter |
| del | deletion 欠失 | del(5)(q13q33):5q13-q33領域の腕内欠失 del(5)(q13):5q13から長腕末端までの端部欠失 |
| der | derivative chromosome 派生染色体 | der(18)t(14;18)(q32;q21) 14q32と18q21の転座によって形成される2つの異常染色体のうちのセントロメアが18番染色体のもの。 18p末端から18q21までの18番染色体部分に14q32から14q末端までの14番染色体部分がつながっている。 |
| add | additional material of unknown origin 過剰部分付加染色体 | add(12)(p13) 12p13部分より末端が欠失し、その部分に由来不明の染色体部分が付加している。 |
| mar | marker chromosome マーカー染色体 | +mar 構造異常を有する由来不明の染色体 同じものが2個ある時は+2mar 異なるものが複数ある時は+mar1,+mar2,… |
| r | ring chromosome 環状染色体 | +r 同じものが2個ある時は+2r 異なるものが複数ある時は+r1,+r2,… 由来染色体(例、7番染色体)が判明している場合は+r(7) 融合部位までわかっていれば+r(7)(p22q36) |
| slとsdl | stemline 中心となるクローン | 46,XY,inv(16)(p13.1q22)[10]/47,sl,+22[10] サブクローンを記載する時に中心となるクローンを省略して記載 する。ここでの47,sl,+22は47,XY,inv(16)(p13.1q22),+22の省略形であり、inv(16)(p13.1q22)は20細胞にみられることを意味する。 複数のサブクローンが存在する場合にはslに加えてsdlを用いる。 46,XY,t(9;11)(p22;q23)[14]/47,sl,+8[5]/48,sdl1,+6[1]における48,sdl1,+6は48,XY,+6,+8,t(9;11)(p22;q23)を意味する。 |
| idem | ラテン語でsameの意味 | 46,XY,t(8;21)(q22;q22.1)[12]/46,idem,del(9)(q13q22)[8] slと同じように用いられる。 |
| dup | duplication 重複 | dup(2)(q11.2q37) 1q22-q25部分の重複 |
| +,- | 染色体の増減 | +8:8番染色体の増加 -7:7番染色体の減少 +add(1)(p11),+mar1,+r1:異常染色体の増加 |
| ? | 不明 | del(9)(q?) 9qに欠失が認められるものの、正確な欠失部位は不明 |
- 滝 智彦
- 杏林大学保健学部臨床検査技術学科教授
本症例集で取り上げた症例の中央診断においては下記の方々(敬称略)のご指導・ご尽力をいただきました。厚く御礼申し上げます。
多和昭雄、足立壯一、多賀崇、林泰秀、高橋浩之、松下弘道、清河信敬、出口隆生、照井君典、橋井佳子、太田秀明、鶴澤正仁、駒田美弘、横澤敏也、堀部敬三、伊藤雅文(日本小児がん研究グループ 血液腫瘍分科会)
矢部みはる、蟹由公子(東海大学医学部基盤診療学系臨床検査学)
田中由美子(東海大学医学部付属病院)
- ※Copyright 2021 株式会社 ビー・エム・エル All rights reserved.
このページ表示されているすべての情報(画像、図、表、文章等)の無断転載を禁じます。