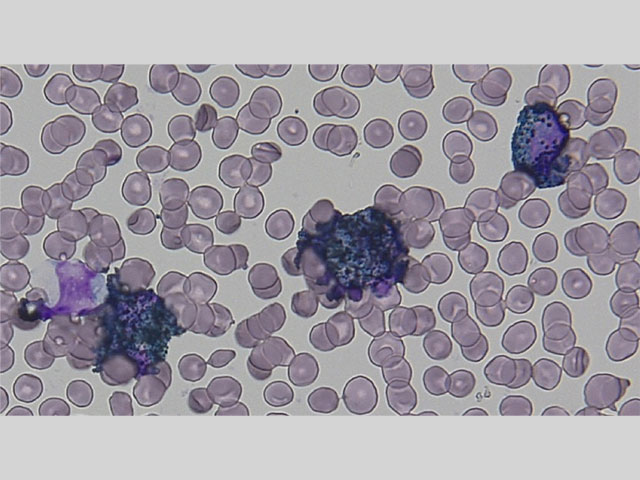
Acute promyelocytic leukemia with PML-RARA
[概要]
異常な前骨髄球の増加が特徴の病型で、多くの症例でt(15;17)(q24.1;q21.2)の染色体転座を認めるが、染色体の欠失や複雑核型のためこの転座が同定できない症例もあり、WHO分類2017年版からAcute promyelocytic leukemia (APL) with PML-RARAと表記されるようになった。典型例であるhypergranular typeと非典型例であるmicrogranular typeがあり、FAB分類では前者はM3、後者はM3 variantとされる。
AML全体の5%~8%の発症頻度で、とりわけラテン系の国やアジアで頻度が高く、比較的若年者に多い。治療前や治療初期に合併するDICにより重篤な出血症状を呈するため、迅速な診断が求められる。レチノイン酸や亜ヒ酸が有効で、AMLの中では良好な治療成績が認められている。
[症例1]
10歳、男性。5日前より38度台の発熱が出現。2日前より体幹に紫斑を認め、しだいに増加したため来院。既往歴、家族歴に特記すべきことなし。身体所見では顔色不良、胸腹部、四肢に大小不同の紫斑を多数認める。
[末梢血検査所見]
| WBC | 2300/μL |
| Blast | 4% |
| Myelo | 2% |
| Promyelo | 68% |
| Seg | 5% |
| Stab | 5% |
| Lympho | 11% |
| Mono | 3% |
| Eosino | 2% |
| RBC | 274万/μL |
| Hb | 8.0g/dL |
| Ht | 24.5% |
| MCV | 97.6fL |
| PLT | 1.2万/μL |
| Ret | 0.8% |
| PT(INR) | 1.11 |
| APTT | 33.3秒 |
| Fibrinogen | 66.0mg/dL |
| FDP | 103.8μg/mL |
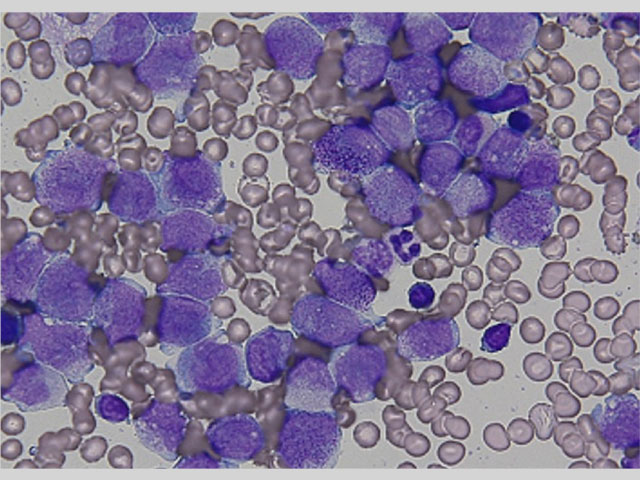
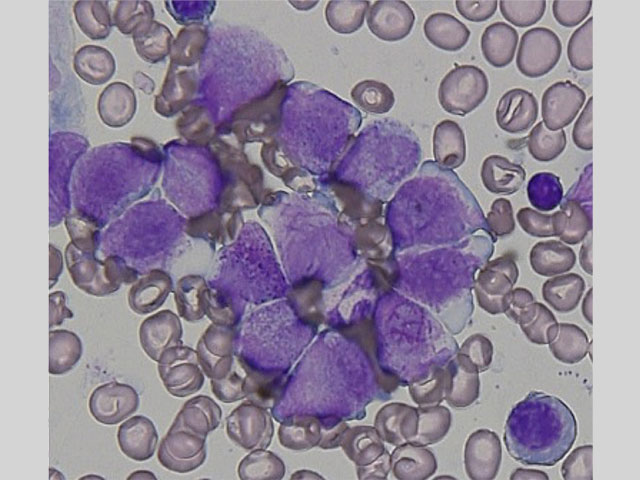
[骨髄形態診断]
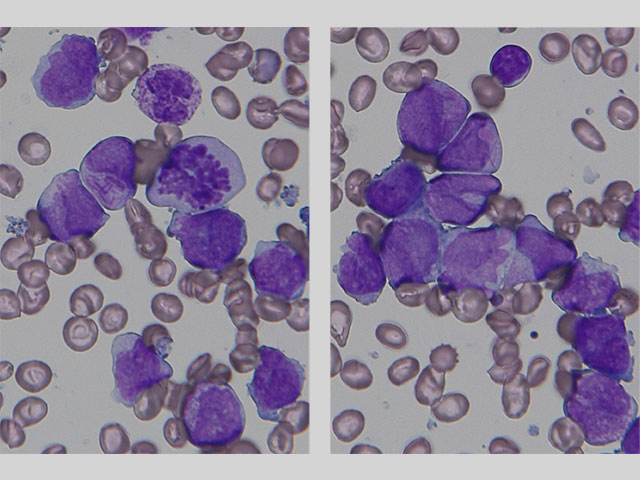
骨髄は過形成、顆粒球系優位で巨核球系は減少している。骨髄芽球の増加は認めない。造血3系統の細胞に明らかな異形成を認めない。前骨髄球を76.6%認める。これらは中型〜大型、好塩基性の細胞質に豊富なアズール顆粒を有し、2分葉、腎臓型などの核不整が認められる。アウエル小体を有する前骨髄球、複数のアウエル小体を有するファゴット細胞が認められる。特殊染色では前骨髄球はMPO染色強陽性である。
[骨髄血細胞表面マーカー]
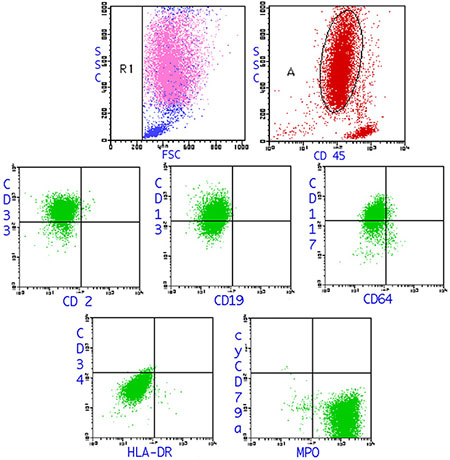
| マーカー | 陽性率(%) |
|---|---|
| CD33 | 91 |
| CD13 | 66 |
| CD34 | 1 |
| HLA-DR | 0 |
| CD64 | 4 |
| MPO | 99 |
| CD117 | 74 |
[染色体・遺伝子検査]
[染色体]G分染法(PHA無添加24・48時間培養)
47,XY,+8,t(15;17)(q24.1;q22.2)[18]
46,XY[2]
[キメラ遺伝子スクリーニング]
PML-RARA 53700 コピー/μg RNA
[FLT3-ITD]
検出されず
[解説]
APLの末梢血検査所見は、本症例のように血小板減少が著しく、白血球数は比較的低めで、汎血球減少を示すことが多い。末梢血塗抹標本を注意深く観察し、異常な前骨髄球を探すことが重要である。FDPの異常高値などDICを示唆する所見もこの病型に特徴的所見である。
骨髄検査では、顆粒の多い前骨髄球の増加や2分葉、腎臓型などの核不整、ファゴット細胞などがAPLに特徴的である。
細胞表面マーカーはCD13、CD33、CD117、MPOの骨髄系マーカーが陽性であるが、他のAMLでは陽性を示すことの多いHLA-DR、CD34が陰性を示す症例が多い。DICなどの臨床症状および骨髄形態診断と細胞表面マーカーからAPLが疑われた場合、速やかにATRAなどの治療を始めることが推奨されている。
染色体および遺伝子解析では、t(15;17)(q24.1:q21.2)の核型に合致してPML-RARA融合遺伝子が検出される。ときにt(15;17)(q24.1:q21.2)の核型異常が検出されないcrypticなタイプもあり、この場合はFISHでの検討が有用である。
[症例2]
13歳、女性。7日前より鼻出血を繰り返し、近医耳鼻科で止血処置を受けていた。3日前より歯肉出血が持続し、前医で血液検査を行ったところ汎血球減少があり、紹介受診。既往歴、家族歴に特記すべきことなし。身体所見では、顔色不良と胸腹部、四肢に大小不同の紫斑を多数認める。
[末梢血検査所見]
| WBC | 2000/μL |
| Blast | 13% |
| Myelo | 2% |
| Promyelo | 2% |
| Seg | 5% |
| Stab | 1% |
| Lympho | 43% |
| Mono | 1% |
| Eosino | 1% |
| RBC | 247万/μL |
| Hb | 6.4g/dL |
| Ht | 24.1% |
| MCV | 88.3fL |
| PLT | 2.4万/μL |
| Ret | 0.8% |
| PT(INR) | 1.18 |
| APTT | 38.0秒 |
| Fibrinogen | 112mg/dL |
| FDP | 187.2μg/mL |
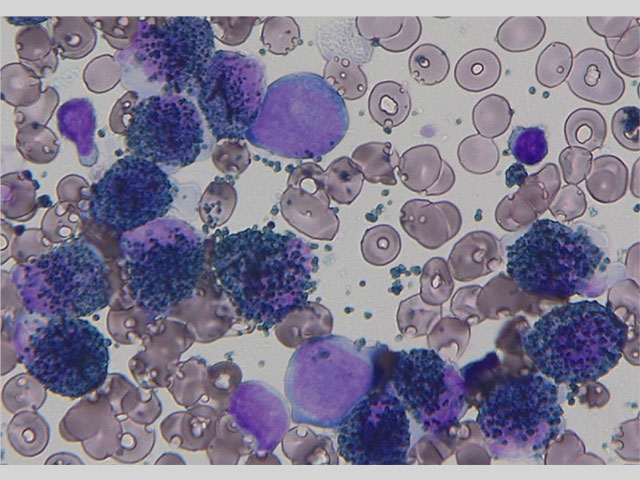
[骨髄形態診断]
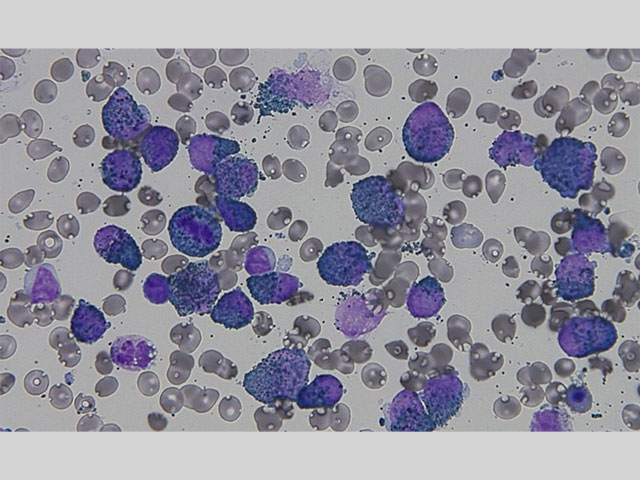
骨髄は軽度過形成、顆粒球系が著しく優位で、巨核球系は減少している。骨髄芽球の増加はみられない。前骨髄球を89.2%認める。前骨髄球は大型、細胞質は灰青色で辺縁は好塩基性、顆粒は少なく微細顆粒状である。核網は繊細で、核は不整形なものが目立つ。アウエル小体を有する前骨髄球やファゴット細胞を認める。前骨髄球はMPO染色強陽性である。
[骨髄血細胞表面マーカー]
| マーカー | 陽性率(%) |
|---|---|
| MPO | 85 |
| CD117 | 26 |
| CD13 | 72 |
| CD15 | 37 |
| CD33 | 56 |
| CD64 | 41 |
| CD65 | 64 |
| HLA-DR | 2 |
| CD34 | 2 |
[染色体・遺伝子検査]
[染色体]G分染法(PHA無添加24・48時間培養)
46,XX,t(15;17)(q24.1;q21.2)[20]
[キメラ遺伝子スクリーニング]
PML-RARA 49800 コピー/μg RNA
[FLT3-ITD]
検出されず
[解説]
APLには前骨髄球の顆粒が過形成を示すhypergranular typeと顆粒が微細顆粒状である microgranular typeがある。本症例は、アウエル小体やファゴット細胞、不整形の核のなどのhypergranular typeと共通する所見を認める一方、前骨髄球の細胞質内顆粒は少なく微細顆粒状でmicrogranular typeに合致する所見が認められた。前骨髄球はMPO染色強陽性を示し、細胞表面マーカーもMPO、CD13、CD33、CD64、CD65が陽性を示しているが、HLA-DR、CD34などの未熟な骨髄系細胞に発現する抗原は陰性である。
[症例3]
3歳、男性。10日前より37度台の発熱と咳が出現。血液検査を行ったところ白血球の上昇を認めた。既往歴、家族歴に特記すべきことなし。身体所見にも特記すべき異常は認められない。
[末梢血検査所見]
| WBC | 29600/μL |
| Blast | 1% |
| Myelo | 14% |
| Promyelo | 2% |
| Seg | 15% |
| Stab | 5% |
| Lympho | 54% |
| Mono | 3% |
| Eosino | 3% |
| Metamyelo | 3% |
| RBC | 459万/μL |
| Hb | 13.3g/dL |
| Ht | 37.7% |
| PLT | 13.9万/μL |
| Ret | 0.2% |
| PT(INR) | 1.06 |
| APTT | 27.0秒 |
| Fibrinogen | 240mg/dL |
| FDP | 8.5μg/mL |
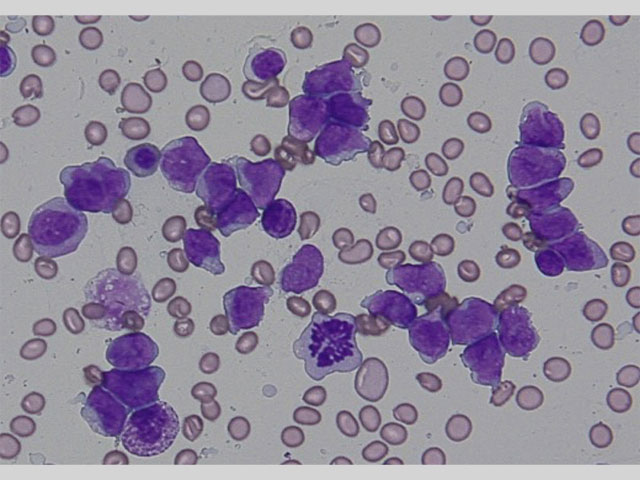
[骨髄形態診断]
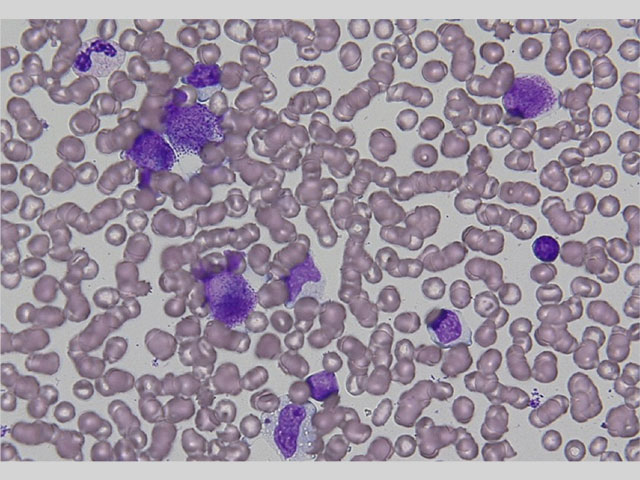
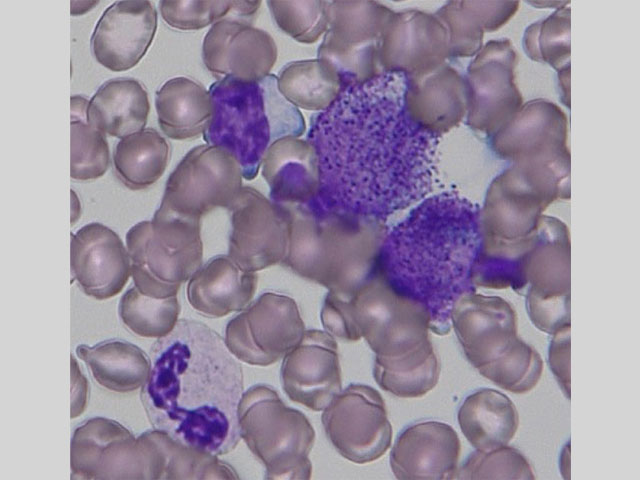
骨髄は低形成、赤芽球系は減少、顆粒球系は成熟球が軽度減少し、これらの細胞の50%未満に偽ペルゲル核異常を認める。中型〜大型で、大型のアズール顆粒をもつ前骨髄球が42.1%と増加している。核網は繊細で核小体はみられない。 アウエル小体やファゴット細胞は認められない。前骨髄球はMPO染色が強い陽性を示している。巨核球は標本上に認められない。
[骨髄血細胞表面マーカー]
| マーカー | 陽性率(%) |
|---|---|
| MPO | 97 |
| CD117 | 96 |
| CD13 | 93 |
| CD33 | 78 |
| HLA-DR | 1 |
| CD34 | 1 |
[染色体・遺伝子検査]
[染色体]G分染法(PHA無添加24・48時間培養)
46,XY,del(1)(p?),add(7)(q32),del(11)(q?),-14,-16,-16,-17,-22,+mar1,+mar3,+mar4,+mar5[15]
46,sl,add(21)(p11.2),-mar5,+mar6[4]
46,XY[8]
FISH
100細胞中PML-RARA融合シグナルは0.0%
しかし、PML:2/RARA:3の異常シグナルを76%認めた
[キメラ遺伝子スクリーニング]
PML-RARA 250コピー未満/μg RNA
NUMA1-RARA陽性(定性PCR)
[FLT3-ITD]
検出されず
[解説]
APLの95%~98%はPML-RARAを有しており、WHO分類ではAPL with PML-RARAという用語が採用されているが、残りの2%~5%ではPML以外の遺伝子とRARAとが融合遺伝子を形成しており、variant RARA translocationと呼ばれる。本症例は異常前骨髄球の増加からAPLが疑われたが、DICの症状はなく、また、PML-RARA融合遺伝子やt(15;17)(q24.1;q21.2)の染色体転座は検出されず、その後のキメラ遺伝子の解析でNUMA1-RARAが検出された。
FISH検査でPML-RARAシグナルは検出されなかったものの、PML以外との転座を示唆するシグナルが検出されたことが診断の契機となった。
NUMA1-RARAはt(11;17)(11q13.4;q21.2)によって形成されるが、それぞれの遺伝子の向きがNUMA1がテロメアからセントロメア方向、RARAがセントロメアからテロメア方向と互いに逆方向のため、単純な相互転座とはならない。本症例の染色体異常にはdel(11)(q?)、-17(5つあるマーカー染色体のどれかがおそらく17番由来の異常染色体?)など、11番染色体と17番染色体が関与した異常が含まれており、これらの染色体異常によりNUMA1-RARAが形成されたと推測される。
参考文献
- Takahashi H, Watanabe T, Kinoshita A, et al. High event-free survival rate with minimum-dose-anthracycline treatment in childhood acute promyelocytic leukaemia: a nationwide prospective study by the Japanese Paediatric Leukaemia/Lymphoma Study Group. Br J Haematol. 174:437-43. 2016
- Rahman K, Gupta R, Singh MK, et al.The triple-negative (CD34-/HLA-DR-/CD11b-) profile rapidly and specifically identifies an acute promyelocytic leukemia Int J Lab.40(2):144-151,2018
Copyright 2021 株式会社 ビー・エム・エル All rights reserved.
このページ表示されているすべての情報(画像、図、表、文章等)の無断転載を禁じます。